
|
|
Starenje i mozak: Od evolucijskih teorija
do molekularnih mehanizama
doc. dr.sci. Goran Šimić, dr. med.
Zavod za neuroznanost Hrvatskog instituta za istraživanje mozga
Medicinskog fakulteta Sveučilišta u Zagrebu
1. Evolucijske teorije starenja
1.1. Teorija programirane smrti organizama uslijed
ograničenog broja diobi somatskih stanica
1.2. Teorija akumulacije mutacija
1.3. Teorija antagonističke pleiotropije
1.4. Teorija neinvestiranja u somatske stanice
i kritika evolucijskih teorija
2. Sistemske teorije starenja
3. Eksperimentalni pristupi proučavanju starenja
4. Mehanizmi staničnog starenja u mitotički aktivnih stanica
4.1. Genetska nestabilnost
4.2. Skraćivanje telomera
5. Mehanizmi staničnog starenja u mitotički neaktivnih stanica
5.1. Oksidativno oštećenje slobodnim radikalima
kisika
5.2. Mutacije mitohondrijalne DNA
6. 'Normalno' starenje mozga i budućnost istraživanja procesa
starenja čovjeka
1. Evolucijske teorije starenja
Tumačenje procesa starenja organizama u kontekstu Darwinove teorije biološke evolucije putem prirodnog odabira znači da se razlike u brzini starenja između različitih vrsta pokušaju objasniti kroz procese mutacije i odabira gena. Četiri su glavne evolucijske teorije starenja organizama: 1. teorija programirane smrti organizama Augusta Weismanna (1889. g.), 2. teorija akumulacije mutacija Petera Medawara (1952. g.), 3. teorija antagonističke pleiotropije Georgea Williamsa (1957. g.) i 4. teorija neinvestiranja u somatske stanice Toma Kirkwooda i Robina Hollidaya (1979. g.). Teorija programirane smrti organizma (ne brkati ovaj pojam s programiranom smrti stanica koja nije specifična za starenje; prema mnogobrojnim novijim nalazima za starenje je to prije nemogućnost izvršenja apoptoze, tzv. abortoza) je u potpunosti odbačena kao pogrešna, dok se ostale naveden teorije međusobno ne isključuju, no u svjetlu novijih nalaza takoder imaju brojne manjkavosti.
1.1. Teorija programirane smrti organizama uslijed ograničenog broja diobi somatskih stanica
Weismannova teorija programirane smrti organizama temelji se na ideji da postoje specifični mehanizmi programirane smrti odabrani prirodnim odabirom radi uklanjanja starih i nepotrebnih članova populacije i na taj način oslobodio prostor i resursi za mlađe generacije. Weismann je vjerojatno došao na ovu ideju nakon čitanja eseja Alfreda Russela Wallacea u kojem je ovaj zapisao: '...nakon što jedan ili više organizama osigura dovoljan broj potomaka, zbog ograničenosti prirodnih resursa i stalnog porasta broja potomaka, oni počinju predstavljati smetnju, te ih prirodni odabir uklanja tako što favorizira one vrste kod kojih organizmi umiru neposredno nakon ostavljanja potomstva'. Da bi objasnio točan biološki mehanizam za svoju teoriju Weismann je pretpostavio da možda postoji prag u broju dioba somatskih stanica koji bi bio specifičan za različite vrste, te da je ovaj limit određen vec u embrionalnim stanicama. Iako se isprva, nakon što je Ross Harrison izumio tehniku kulture stanica, prema rezultatima Alexis Carrel (1912) i Alberta Ebelinga (1913) mislilo da se fibroblasti pileta mogu kultivirati neograničeno dugo (ili najmanje 34 godine), serijom izvanrednih eksperimenata na 23 soja fibroblasta iz različitih tkiva zeca i pileta, te 51 soja fibroblasta iz različitih tkiva čovjeka, konačno je H. Earle Swim 1959. godine pokazao da: a) sve stanice u kulturi prije ili poslije pokazuju nespecifičnu degeneraciju koja nije metodološki artefakt i b) da kultivacija stanica karakteristično pokazuje tri stadija: u prvom nakon odredenog počeka stanice brzo proliferiraju i mogu se transferirati bez poteškoća, u drugom nastaje smanjenje dioba i smrt uslijed nespecifične degeneracije, dok u trećem u rijetkim slučajevima dolazi do aktivne proliferacije nekih stanica iz drugog stadija, a ovakve stanice razlikuju se od normalnih i po morfologiji i po kinetici diobe (tumorske stanice). Ove je nalaze još detaljnije elaborirao Leonard Hayflick, pa je limit u broju dioba stanica nazvan Weismann-Swim-Hayflickov limit. Pred kraj svog života Weismann je sam shvatio neodrživost svoje teorije o programiranoj smrti organizama, te se priklonio mišljenju da je smrt starijih organizama zapravo nebitna i u načelu neutralna za odredenu vrstu, te da je u regulaciji duljine života jedino bitna ona prednost koju starost daje za vrstu, a ne za jedinku.
Jedan od načina testiranja teorije programirane smrti organizama temelji se na usporedbi duljine života jedinki odredene vrste u prirodnoj i zaštićenoj okolini (npr. laboratoriju). Naime, kada bi hipoteza bila točna ne bi trebalo biti velikih razlika u starosti izmedu odraslih jedinki iz ovih dviju skupina. Štoviše, da bi jedan takav samouništavajući mehanizam djelovao i bio genetski zadržan, on bi morao imati makar i malenu vjerojatnost da se i očituje u prirodnim okolnostima. Dob pri kojoj bi se aktivirao ne bi smjela biti previsoka, jer bi se inače uslijed visokog mortaliteta zbog nedostatka hrane, predatora, infekcija i drugih nepovoljnih prirodnih uvjeta lako mogao izgubiti. Iz ovoga slijedi da duljina trajanja života čak i u najboljim mogućim uvjetima ne bi smjela biti veća od dobi koju su doživjele najstarije jedinke. Analiza podataka, medutim, pokazuje upravo suprotno: duljina trajanja života svih organizama u zaštićenoj okolini daleko nadmašuje onu u prirodnim okolnostima. Na primjer, medijan duljine života (starost kod 50%-tnog preživljenja) čimpanzi koje žive u zatočeništvu je izmedu 23 godine za mužjake i 30 godina za ženke, a gotovo 20% takvih ženki doživi starost od 50 godina. U prirodnim, 'divljim' okolnostima, medijan duljine života iznosi samo 8 godina i gotovo ni jedna jedinka ne doživi starost od 50 godina. Ovakva opažanja vrijede za većinu vrsta, a također i za čovjeka. U današnje vrijeme je prosječno očekivano trajanje života ljudi u razvijenim zemljama svijeta izmedu 70 i 80 godina, dok je dokumentirani rekord u dugovječnosti 122 godine. Kad uzmemo ove podatke za procjenu dobi u kojoj bi nastupila programirana smrt organizma vidimo da se takav program nije mogao javiti u tijeku evolucije čovjeka jer, prema paleodemografskim podacima, ni jedna jedinka nije doživjela tako visoku starost. Na primjer, svega je 50% ljudi iz kasnog paleolitika (prije 10-30000 godina) doživjelo starost od 8-9 godina, te je svega 50% ljudi iz neolitika (prije 4-10000 godina) doživjelo 26 godina. Čak i u srednjem vijeku (9-12 stoljece) očekivano trajanje života nije bilo veće od 27-29 godina. Proučavanja kostura američkih Indijanaca pokazala su da ih je samo 4% doživjelo dob od 50 godina u kasnom 18 stoljeću. Stoga je jasno da zajamčeno samouništenje malog postotka starijih ljudi koji su doživjeli stariju dob igrom slučaja nije dovoljan evolucijski temelj za stvaranje i održavanje posebnog mehanizma samouništenja u genomu covjeka.
Da teorija programirane smrti organizama nije valjana lako je dokazati i proučavanjem životnih tablica pojedinih vrsta, jer kad bi ova teorija bila točna tada bi se stupanj smrtnosti trebao dramatično promijeniti nakon neke kritične dobi, a ova bi se promjena na krivulji trebala jasno vidjeti barem u genetički identičnih životinja uzgajanih u istim laboratorijskim uvjetima. Rezultati opet pokazuju upravo suprotno: ovisnost stupnja smrtnosti o dobi vrlo je glatka krivulja koja se sastoji od inicijalnog eksponencijalnog dijela, a nakon neke starije odrasle dobi nastupa plato. Ova tzv. Gompertz-Makehamova krivulja slična je u svih vrsta i u njoj nema nikakvih znakova neke kritične starosti nakon koje bi mortalitet jako porastao. Krivulja nam daje i najtočniju definiciju starenja, a to je (pored karakterističnih promjena fenotipa) da vjerojatnost smrti u bilo kojoj točki u vremenu raste sa starošću organizma. Kod čovjeka krivulja počinje eksponencijalno rasti nakon dobi od 20 godina, a plato nastupa s negdje oko 85 godina starosti. U toj izrazito staroj dobi nastupa čak i smanjenje stupnja smrtnosti (tj. stupanj smrtnosti je i manji no što bi se očekivalo prema idealno monotonom Gompertz-Makehamovom modelu), a to je opet suprotno modelu programirane smrti organizama. Konačno, treći glavni dokaz nevaljanosti teorije programirane smrti organizama je činjenica da bi poseban mehanizam za uništavanje života teško pomogao jedinki da se uspješno bori kako za vlastito, tako i za preživljenje svojih potomaka. Štoviše, one jedinke u kojih bi taj mehanizam samouništenja bio oštećen uslijed kakve spontane mutacije brzo bi nadvladale preostale, jer bi dale više potomstva ili bi u najmanju ruku pružile vlastitom potomstvu dulju roditeljsku skrb.
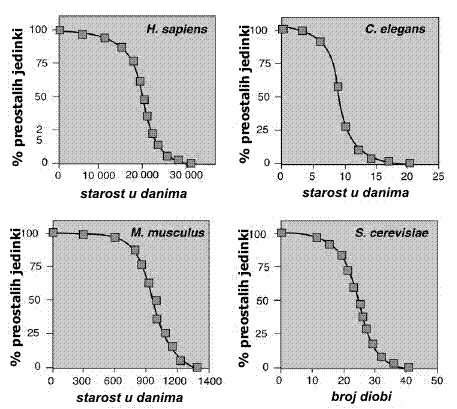
Krivulje preživljenja čovjeka, miša, crva oblića i kvasca
1.2. Teorija akumulacije mutacija
Teorija akumulacije mutacija Petera Medawara promatra starenje kao nusprodukt prirodnog odabira, odnosno smatra da ne postoji selekcijski tlak za dugovječnost: genetski smo programirani samo da doživimo toliko dugo da bi smo se reproducirali, a nakon toga brojni unutarnji i vanjski utjecaju uzrokuju smrt. Za prirodni odabir nije bitno što će se dogoditi sa starijim jedinkama vrste koje ne doprinose nastanku novog potomstva. Ovo je objašnjenje starenja zapravo analogija evolucijskog objašnjenja npr. deterioracije vida u spiljskih životinja: ako se neka funkcija ne može iskoristiti u svrhu reproduktivne prednosti, ona niti neće biti podržana selekcijskim tlakom i zadržati se u budućim generacijama. Vjerojatnost jedinke da se reproducira iznosti nula u trenutku rođenja i dostiže svoj maksimum u mladih odraslih jedinki, a zatim uslijed povećane vjerojatnosti smrti uslijed raznih vanjskih i unutrašnjih uzroka pada. Štetne mutacije koje se eksprimiraju u mlađoj dobi stoga su podložne jakom probiru, dok one koje se eksprimiraju u starijoj dobi nakon reprodukcije imaju malu mogućnost da bi se prirodnim odabirom odstranile iz genoma. Tako na primjer, bolesnici s Hutchinson-Guilford progerijom žive u prosjeku samo 12 godina i ne mogu prenijeti svoje mutirane gene na slijedeće generacije. Bolest je jako rijetka (u posljednjih 100 godina zabilježeno je sveukupno samo oko 100 bolesnika, a trenutno ih ima 30-tak), jer nastaje samo uslijed spontanih mutacija. Nasuprot tome, osobe kod kojih ekspresija mutacije poprima patološke razmjere tek u starijoj dobi mogu dati potomstvo i prije nego što nastupi bolest, kao npr. u slučajevima obiteljske Alzheimerove bolesti, pa se takvi geni mogu prenositi i kumulirati u slijedećim generacijama. Ova teorija stoga predviđa da učestalost genetskih bolesti u starijoj dobi raste s porastom broja godina života, dovodeći tako do sve većeg stupnja mortaliteta. Prema teoriji akumulacije mutacija za očekivati je da genetska varijabilnost za duljinu trajanja života raste sa dobi, te stoga duljina života potomaka ne bi trebala biti linearno ovisna o duljini života roditelja, kao npr. s visinom tijela. Umjesto toga, ova bi ovisnost trebala imati nelinearan oblik s povećanom povezanošću izmedu duljine života onih potomaka čiji roditelji žive duže. I doista, pomoću genealoških tablica kraljevskih i drugih europskih porodica 'plave' krvi (poznatih po svojoj pouzdanosti i točnosti) dokazano je da je ovisnost duljine života potomaka o duljini života roditelja sve veća što je životni vijek roditelja veći, upravo kao što to predviđa teorija akumulacije mutacija. Ovo predvidanje je direktan izvod ključnog dijela teorije što kaže da bi ravnotežna učestalost gena za štetne mutacije trebala rasti sa starenjem u vrijeme početka mutirajućeg djelovanja uslijed slabijeg (odgođenog) odabira protiv mutacija koje 'djeluju' u kasnoj dobi (izraz 'ravnotežna učestalost gena' ovdje se odnosti na krajnju učestalost gena, neovisnu o vremenu, a koja je određena ravnotežom izmedu stupnja mutiranja i stupnja odabira).
1.3. Teorija antagonističke pleiotropije
Teorija antagonističke pleiotropije (ili 'platit ćeš kasnije' teorija) Georga Williamsa temelji se na dvije pretpostavke. Prva je da određeni gen može imati učinak ne samo na jedno svojstvo nego na više svojstava organizma (pleiotropija), a druga da ovi pleiotropni ucinči mogu djelovati na stupanj prilagođenosti jedinke na suprotne (antagonističke) nacine. Teorija je proistekla iz zapažanja da je u slučaju postojanja sukoba interesa gena prirodni odabir uvijek pristran u korist mlađe dobi. Prema Williamsu, ovaj sukob nastaje uslijed pleiotropnih gena koji imaju suprotne učinke na prilagođenost jedinke u različitoj dobi. Drugim riječima, mutacija gena koji ce dati prednost u razdoblju najveće reproduktivne vjerojatnosti povećat ce ukupnu reproduktivnu vjerojatnost više nego što će je proporcionalno sličan gubitak smanjiti u kasnijoj dobi. Stoga će prirodni odabir maksimizirati snagu mladosti na račun sposobnosti preživljavanja u kasnijem tijeku života. Za ilustraciju, pretpostavimo da neki gen povećava ugradnju kalcija u kosti. Ako ovakav gen ima pozitivan učinak u ranom životu jer smanjuje rizik od frakture kostiju i posljedične smrti, on kasnije može imati negativan učinak jer povećava rizik od osteoartritisa uslijed prekomjerne kalcifikacije. U prirodnim okolnostima ovakav gen zapravo nema većeg utjecaja jer većina jedinki umre i prije nego li dođe do izražaja negativan učinak. Učinak se vidi jedino kada životinje žive u uvjetima zaštite, npr. u zoološkom vrtu ili laboratoriju. Još jedan primjer koji bi mogao govoriti u prilog antagonističkoj pleiotropiji je ograničeni broj staničnih diobi. Budući je dokazano da stare stanice u većoj mjeri od mladih stimuliraju premaligne i maligne stanice na proliferaciju i stvaranje tumora, isti proces koji u tijeku razvitka i mlađoj dobi suprimira tumorigenezu, možda je kasnije promovira. Ovdje bi se ponovno moglo raditi o 'naplati' ranijeg zaštitnog ucinka. Teorija antagonističke pleiotropije objašnjava zašto dobra reprodukcija može biti kobna za duljinu života pojedine vrste, sve do te mjere da može inducirati i smrt. Najpoznatiji ovakvi primjeri su 'samoubilački' životni ciklusi bambusa i pacifičkog lososa. Bambus se reproducira vegetativno (aseksualno) vrlo sporo kroz otprilike 100 godina, a zatim u jednoj jedinoj sezoni sve biljke s jednog polja cvjetaju simultano, reproducirajući se seksualnim putem, i odmah potom umiru. Nakon 100 godina ponavlja se isti ciklus. Antagonistička pleiotropna teorija može objasniti čak i ove ekstremne primjere, jer prema njoj svaka mutacija koja favorizira intenzivnu produkciju većeg broja potomaka propagirat će se na buduce generacije, čak i ako ove mutacije budu imale letalne učinke odmah nakon reprodukcije. U ovakve primjere mogle bi se također svrstati mutacije koje uzrokuju npr. višak spolnih hormona, povećavaju spolnu želju ili učinkovitost spermija, bez obzira što kasnije u životu mogu dovesti do nastanka npr. karcinoma testisa, ovarija ili prostate.
U svjetlu svoje teorije Williams je predvidio da će uspješan odabir za produljeni život dovesti do smanjenja reproduktivne sposobnosti u mlađoj dobi. Ovo pređvidanje je eksperimentalno testirao Michael Rose započevši 1976. godine eksperiment na Sveučilištu u Sussexu. U nekoliko boca mlijeka smjestio je 200 vinskih mušica i nakon 5 tjedana, kad su mušice došle pred kraj reproduktivnog razdoblja, pokupio jajašca, uzgojio ih i ponovio isti postupak nadajuci se da će živjeti nešto duže nego prethodna generacija. Od početnih 200, sada ima više od milijun mušica, a eksperiment svakodnevno nastavlja veći broj asistenata na Sveučilištu Irvine u Kaliforniji. Današnji potomci prvobitnih mušica žive u prosjeku dvostruko duže (oko 120 dana), što bi kod čovjeka odgovaralo dobi od oko 150 godina, te i nadalje žive sve dulje i dulje. Dakle, odgadajući reprodukciju do kasne fertilne dobi, intenzitet probira za dulji život je porastao. Ovaj je eksperiment dokazao: a) da geni igraju važnu ulogu u starenju jer mušicama nije poboljšana kvaliteta života i time očekivano trajanje života, vec maksimalni životni vijek, a geni nisu poboljšani intervencijom nego parenjem, i b) da vjerojatno postoji veći broj gena uključenih u starenje, jer da ih je malo, oni bi bili probrani vec nakon nekoliko generacija. No, glavni nedostatak ovog eksperimenta jest da je smjer probira prema dugovječnosti umjetno nametnut budući su uzimane zaštićene jedinke što se reproduciraju u kasnoj dobi. U prirodnim uvjetima je mala vjerojatnost da bi one doživjele tu dob u tolikom broju i ušle u prirodni odabir. Stoga ovaj eksperiment ne može odijeliti učinak odabira kasne reprodukcije na dugovječnost od učinka direktnog odabira svojstva dugovječnosti. Ipak, eksperiment je potvrdio pretpostavku teorije antagonističke pleiotropije, jer je nađeni porast dugovječnosti vinskih mušica bio upravo razmjeran smanjenoj fertilnosti u ranoj odrasloj dobi, a također i produljenom razdoblju razvitka do odrasle jedinke. Williams je također predvidio da bi trebalo vrijediti i suprotno, tj. da bi brži razvitak jedinke do reproduktivne zrelosti trebao pozitivno korelirati s bržim starenjem. No, iako je i ovo pređvidanje testirano na vinskoj mušici, nije nadena linearna povezanost izmedu brzine razvitka do spolne zrelosti i duljine života. U novije vrijeme potraga za 'razmjenom' izmedu dugovječnosti i uspješne reprodukcije načinjena je i u crva oblića Caenorhabditis elegans gdje su otkrivene brojne mutante s produljenim životnim vijekom. Kada su dugoživuće mutante bile držane zajedno s normalnim, divljim tipom crva u uobičajenim uvjetima, suprotno predviđanju, nijedna od ovih mutanata nije pokazivala prednosti u odnosu na divlji soj. No, kada su sojevi bili izloženi razdobljima izgladnjivanja, čime su oponašane prirodne okolnosti života crva, mutante su brzo po brojnosti nadmašile divlji tip. Ovaj nalaz ukazuje na činjenicu da bi porast trajanja života ipak imao evolucijsku prednost u teškim prirodnim uvjetima (npr. ciklusima teškog nedostatka hrane), što ova teorija ne može u potpunosti objasniti. Podaci za ljude takoder nisu uvjerljivi. Neke studije opisale su kako je većina dugovječnih ljudi (naročito žena) imala oštećenu reproduktivnu sposobnost, baš kao što to predvida teorija antagonisticke pleiotropije. No, kasnije su ti podaci opovrgnuti, jer je pronađeno da je dio dotičnih dugovječnih osoba ipak imao djecu ili je nisu imale zbog nekog drugog razloga, npr. manjka reproduktivne sposobnosti partnera.
1.4. Teorija neinvestiranja u somatske stanice i kritika evolucijskih teorija
Teorija neinvestiranja u somatske stanice (engl. disposable soma theory, po analogiji s disposable products: zašto trošiti novac na pravljenje nečeg što je trajno, ako će se to koristiti samo kroz ograničeno razdoblje) kaže da starenje nastaje uslijed činjenice da prirodni odabir favorizira manje investiranje organizama u održavanje i popravak somatskih stanica i tkiva nego što je to neophodno za neograničeno preživljenje spolnih stanica. Ova teorija vjerojatno je razvijena na tragu ideje iznesene u popularnoj knjizi 'Sebični gen' Richarda Dawkinsa iz 1976. godine, a to je da su svi organizmi su samo mediji ('survival machines') za preživljavanje 'sebičnih' gena spolnih stanica. Teorija neinvestiranja u somatske stanice Kirkwooda i Hollidaya obrazlaže da starenje nastaje uslijed akumulacije nepopravljenih oštećenja somatskih stanica (dok je stupanj preciznosti održavanja spolnih stanica visok, jer bi inače bile eliminirane). Prema njima genetska kontrola primarno djeluje tako da kroz odabir povećava ili smanjuje investiranje u održavanje temeljnih staničnih sustava u odnosu na stupanj izvanjske opasnosti. Jedan od ključnih ovakvih sustava je sustav za proizvodnju energije u mitohondrijima, a prema ovoj teoriji on i u najvecoj mjeri određuje duljinu života (vidi kasnije). Prema teoriji neinvestiranja u somatske stanice, ako je mortalitet uslijed okolišnih činitelja veći, to manje treba investirati u održavanje somatskih stanica (a više u reprodukciju). Stoga će ovakve vrste imati kraći životni vijek jer je investiranje u održavanje somatskih stanica minimalno. U prilog ovoj teoriji govore brojni primjeri kao što je to tvrdi oklop u dugovječnih kornjača ili pak nalaz da oposumi žive dulje ako im je stanište na otocima gdje nemaju prirodnih neprijatelja.
Utjecaj evolucijskih teorija nije bio uvijek od naročite koristi za proučavanje procesa starenja. Štoviše, budući da su one uvijek polazile od činjenice da zbog izvanredne složenosti i najjednostavnijih bioloških sustava potraga za pojedinačnim mutacijama koje bi imale znatnog utjecaja na produljenje životnog vijeka nema smisla, one su katkad čak i kočile daljnji napredak. Tako je npr. George Williams 1957. godine napisao: 'Starenje je uvijek generalizirana deterioracija, i nikad ne nastaje zbog promjena u jednom sustavu...Ovaj zaključak poništava moguće postojanje 'zdenca mladosti' i stavlja ga u kategoriju znanstveno nemogućeg, zajedno s perpetuum mobile i Laplaceovim 'supermanom'. Iako je ovaj zaključak razočaravajući, njegova je dobra strana to što kanalizira u kojem smjeru istraživanja trebaju poći'. Kao rezultat ovakve evolucionisticke 'indoktrinacije' (obično se navodilo da najmanje 70% gena učestvuje u procesu starenja), mnoge uzbudljive mogućnosti istraživanja bile su zaustavljene (slično se dogodilo i s područjem kloniranja organizama što je uslijed sličnog dogmatiziranog razmišljanja bilo zakočeno od 1981. do 1996. godine). Pa ipak, u posljednjih 15-tak godina svjedoci smo uzbudljivih otkrića mutanti pojedinačnih gena koje dovode do značajnog produljenja životnog vijeka (npr. u kvasca je to delecija RAS1 gena što dovodi do povećanja životnog vijeka za 23%) ili pak, s druge strane, otkrića da prekomjerna ekspresija pojedinih gena dovodi do istog učinka, npr. u kvasca su to: v-Ha-RAS (produljenje životnog vijeka za 70%), RAS2 (20-40%), UTH2/SIR4-42 (45%), UTH4 (20%), LAG1 (60%), LAG2 (36%). U C. elegans se ističu: AGE-1 gen za fosfatidil-inozitol 3 kinazu (1988. god.) - prvootkriveni gen čija mutacija dovodi do produljenog životnog vijeka, ali istovremeno i smanjene reproduktivne sposobnosti, kao i CLK-1 (1996. god.), DAF-1 (transkripcijski činitelj) (1997. god.), DAF-2 (inzulinu-sličan receptor), ISP-1 i drugi geni. U vinske mušice ističe se methusaleh mutacija MTH gena (za s G proteinom spregnuti presinapticki receptor motoričkih neurona) (1998. god.) što dovodi do 35%-tnog produljenja prosječnog trajanja života, a do danas su pronadene i Indy (za kotransporter natrijevog dikarboksilata), chico (za jedan supstrat inzulinskog receptora) i InR (za jedan receptor sličan inzulinu) mutacije što dovode do manjeg, ali također značajnog produljenja životnog vijeka. Kod sisavaca prednjači P66SHC gen (otkriven 1999. god.) čiji proteinski produkt smanjuje oksidativno oštećenje. Navedeni nalazi ukazuju da, suprotno opisanim evolucijskim teorijama, mehanizmi starenja mogu uključivati samo manji broj gena i biti vrlo specifični. Izvanredno je zanimljivo i otkriće da se kombinacijama delecija i prekomjernih ekspresija pojedinih gena može postići aditivni učinak na produljenje životnog vijeka.
Starenje pojedinačnih stanica i starenje organizma su dva često međusobno povezana, ali istovremeno i različita procesa čiji je odnos izvanredno složen i još uvijek uglavnom nepoznat. Jedan od mnogobrojnih primjera za ovo je i nalaz da se broj preostalih diobi fibroblasta ne može procijeniti niti jasno korelira s dobi njihova donora. Do sada je predloženo više od 300 teorija starenja. Iako su ove teorije pokušavale objasniti mehanizam i većinom sve aspekte starenja odjednom, noviji podaci ukazuju da se te mnogobrojne teorije preklapaju, odnosno ima ponešto istine u svakoj od njih, ali ni jedna ne objašnjava sve. Ovo je vjerojatno posljedica činjenice da funkciju organizma treba promatrati kao rezultat mnogobrojnih interakcija, pa pokušaji izolacije pojedinih fenomena neizbježno dovode do iskrivljene slike. Imunološka teorija starenja (Walford, 1962) temelji se na pretpostavci da je starenje uzrokovano smanjenom sposobnošću razlikovanja vlastitih antigena od tuđih i posljedično nastankom protutijela na vlastite antigene. Iscrpljenje klonova limfocita u tom smislu također je pretpostavljano kao jedan od mogućih činitelja koji doprinosi smanjenju imunoloških mehanizama obrane i posljedičnom starenju (Burnet, 1970). U tom smislu možda ima ulogu rana involucija timusa. Neke od također češće spominjanih teorija koje bi mogli svrstati u široku kategoriju sistemskog starenja su teorija trošenja 'vitalnosti' (rate of living theory, Pearle, 1928), teorija starenja zbog nagomilavanja grešaka u sintezi proteina (engl. protein error theory, Orgel, 1963), grešaka u održavanju strukture proteina (chaperon theory, Miyaishi, 1995) i teorija starenja zbog stresa (Selye, 1970).
Teorija stresa kao uzroka starenja pretpostavlja da je svaki organizam opremljen s danom mu količinom adaptivne energije koja se progresivno troši, a starenje u ovom modelu (Selye je razvio model ubrzanog starenja štakora davanjem dihidrotahisterola, koje je mogao prevenirati davanjem spironolaktona) odražava zbroj svih stresova i kompenzatornih reakcija na njih. Učinak stresa na arteriosklerozu, popravak DNA, imunološki odgovor i mnoge druge važne procese na staničnoj i molekularnoj razini dobro je dokumentiran, a to se odnosi i na činjenicu da stres značajno ubrzava starenje. Kao modifikacija ove teorije, iz zapažanja da na neizbježne događaje iz okoline koji izazivaju promjene organizma ovaj nastoji ponovno uspostaviti prijašnje stanje, ali u tome sve slabije uspijeva, razvila se kompenzatorna adaptacijska teorija starenja (Schächter, 1998). S druge strane ima i teorija koje predlažu da male doze stresa produljuju život. Jedna od tih teorija, izmedu ostalog, predložena je kao objašnjenje za produljenje životnog vijeka zbog kalorijske restrikcije jer izaziva umjereni hiperadrenokorticizam (Masoro, 1998). Selyeva teorija stresa tijesno je povezana i s drugim teorijama sistemskog starenja. Te teorije temelje se na uočenim smanjenim koncentracijama cirkulirajućih humoralnih činitelja, poglavito hormona, koji koordiniraju brzinu starenja u mnogim organima i tkivima, i to ponajviše: estrogena (u menopauzi) i testosterona (u andropauzi), DHEA i DHEAS (dehidroepiandrosteron i njegov sulfat) (u adrenopauzi), te hormona rasta i inzulinu-sličnog činitelja rasta (IGF-1) (u somatopauzi). Tako npr. proizvodnja estrogena rapidno slabi nakon menopauze, a procjenjuje se da njegova supstitucija zbog sprječavanja osteoporoze, arterioskleroze i poboljšanja kognitivnih sposobnosti može produljiti život žene, odnosno smanjiti mortalitet i za više od 10 godina (zasad nije potvrđeno da povećava i maksimalni životni vijek, kao što je to 2003. godine pokazano u modelu mutacija receptora za ekdison, glavni steroidni receptor vinske mušice). DHEA je univerzalni prekursor za nastanak androgenih i estrogenih steroida u perifernim tkivima. U čovjeka DHEA i DHEAS u plazmi imaju najveću koncentraciju izmedu 20. i 25. godine života, a nakon toga se koncentracija postupno smanjuje, a s 80 godina je na oko 10-20% ovih vrijednosti. Zbog pozitivnih učinaka na neke simptome starenja, reklame tvrtki koje ga prodaju (pod nazivom 'zdenac mladosti') i mogućnosti da se kupe i bez recepta u posljednjih nekoliko godina DHEA se, kao i hormon rasta, prodaje u masovnim razmjerima i količinama (npr. S.A.D.) iako povoljni, a pogotovo nepovoljni učinci, još uvijek nisu utvrđeni velikim dvostruko-slijepim multicentričnim istraživanjima. Ipak, treba istaknuti da je 2002. godine Baltimorska longitudinalna studija starenja što traje od 1958. godine, a prati 1500 ljudi, pokazala da je od svih proučavanih parametara povećani životni vijek bio povezan samo s 3: manjom tjelesnom temperaturom, manjom prosječnom koncentracijom inzulina i povećanom koncentracijom DHEA.
3. Eksperimentalni pristupi proučavanju starenja
Glavni pristupi identifikaciji patogenih činitelja, gena i metaboličkih putova važnih za starenje uključuju proučavanje nasljednih bolesti preuranjenog starenja (progerija), fiziološke eksperimente što proučavaju odnos brzine starenja i unosa kalorija, te molekularno-biološko proučavanje starenja u eksperimentalnim modelima. U progerije spadaju Wernerov sindrom, Hutchinson-Gilford sindrom, Down sindrom, Cockayne sindrom i Ataxia teleangiectasia. Dok Wernerov i Hutchinson-Gilfordov sindrom nemaju patologije živcanih stanica, Downov i Cockayne sindrom, kao i ataxia teleangiectasia pokazuju izraženu degeneraciju živčanih stanica.
Wernerov sindrom opisao je 1903/1904. godine Otto Werner kao student medicine na Sveučilištu u Kielu u četvoro rođaka koji su u tridesetim godinama života izgledali kao starci (pogrbljeno držanje, tanki udovi, osteoporoza, katarakta, sijeda kosa, gubitak kose, suha i izborana koža, promijenjen glas, arterioskleroza, ulceracije uslijed sporog zacjeljivanja rana, dijabetes, maligniteti, itd.). U dobi od 25 godina on ih je 1905. godine izložio u svojoj disertaciji. Trideset godina kasnije, 1935. Oppenheimer i Kugel opisali su još jednog bolesnika sa sličnim simptomima i nazvali poremećaj Wernerovim sindromom. Očekivana dob života u ovih bolesnika je 44-47 godina. Tek su 1996. godine Shellenberg i Martin otkrili gen na kratkom kraku 8. kromosoma odgovoran za nastanak bolesti (da bi gen bio točno mapiran bilo je potrebno nakon analize povezanosti s pomoću satelitne DNA u suspektnom području odrediti 1.2 milijuna parova baza). Gen kojeg danas nazivamo WRN kodira jednu DNA helikazu. Normalna funkcija WRN proteina je despiralizacija DNA što je potrebno prije svakog popravka DNA, pa se u ljudi s Wernerovim sindromom nagomilavaju delecije i mutacije u mitotički visoko aktivnim stanicama. Wernerov sindrom naslijeđuje se autosomno dominantno jer osobe sa samo jednim lošim alelom ne pokazuju preuranjeno starenje.

Wernerov sindrom
Hutchinson-Guilford sindrom opisali su Jonathan Hutchinson 1886. godine i Hastings Guilford 1904. godine. Trenutno u svijetu ima svega 30-tak oboljelih. Koža ovih bolesnika bora se tako brzo da već mala djeca izgledaju kao starci, a svi umiru prije 20-te godine života. Simptomi i znakovi bolesti uključuju: brzo boranje kože, generaliziranu alopeciju, mali rast, distrofične nokte, usporeno spolno sazrijevanje, karakteristično povećanu ekskreciju hijaluronske kiseline i smanjenu mitotičku aktivnost većine tkiva. Od 6300 do sada pretraženih gena nadeno je 76 mutiranih (15 od njih uključeni su u regulaciju staničnog ciklusa pri mitozi, a od ostalih za fenotip su vjerojatno važne mutacije gena za dezmoplakin-1, mali proteoglikan što se veže za kolagene i gena za galaktozil-transferazu).

Hutchinson-Guilford sindrom
Glavni uzrok neuropatoloških promjena u Down sindromu potjece od jedne suvišne kopije gena za amiloid prekursorni protein na 21. kromosomu, pa stoga svi oboljeli od Down sindroma prije 50 godine života razviju neuropatološke promjene karakteristicne za Alzheimerovu bolest (senilne plakove neki već od 7-8-me godine života, neurofibrilarne snopiće već od 11-12-te godine života).

Down sindrom
Cockayne sindrom je multisistemski autosomno-recesivni poremećaj popravka DNA, a u neuropatološkom nalazu vide se izražena degeneracija retine, kohleje, leukodistrofija, demijelinizacijska neuropatija, intrakranijalne kalcifikacije, neurofibrilarni snopići, tzv. bizarni astrociti itd.. Sindrom se dijeli na CSA (rani) i CSB (kasni) tip. Odgovorni CSA gen pronaden je na 5. kromosomu, dok CSB još nije poznat. Od ostalih simptoma ističe se fotosenzitivni dermatitis i preosjetljivost na ionizirajuće zračenje.
Cockayne sindrom
Ataksija teleangiektazija nastaje zbog nasljednog nedostatka popravka puknuća oba lanca DNA, a takav nedostatak je vrlo čest uzrok karcinogenezi, naročito nastanku leukemija u djece te raka dojke. Odgovorni ATM gen kloniran je 1995. godine, a kodira fosfatidil-inozitol 3 kinazu koja ima važnu ulogu u zaustavljanju staničnog ciklusa i aktivaciji gena uključenih u popravak DNA (naročito SIR2, SIR3 i SIR4 što se nalaze u blizini telomera). Neurološki simptomi uključuju ataksiju i koreoatetozu ('little clowns'), te progresivnu neurološku deterioraciju.
Iz fizioloških eksperimenata što proučavaju odnos brzine starenja i unosa kalorija dobro je poznato da npr. glodavci s kalorijski ograničenom dijetom žive dvostruko dulje, za trećinu su manji, imaju manju tjelesnu temperaturu i manje obolijevaju. Treba naglasiti da je ograničenje kalorijskog unosa još uvijek jedina eksperimentalna intervencija koja nepobitno dovodi do usporenja starenja i produljenja srednje vrijednosti maksimalnog životnog vijeka u svih proučavanih vrsta! Iako još uvijek nije sasvim jasan mehanizam djelovanja kalorijske restrikcije, mnogobrojna novija istraživanja potvrduju pretpostavke da uslijed smanjene razine oksidativne fosforilacije dolazi i do posljedicne smanjene produkcije slobodnih radikala kisika i povećane aktioksidativne sposobnosti, a ove promjene prati smanjenje transkripcije i translacije, te smanjeni opseg oštećenja DNA (vidi kasnije).
Glavni eksperimentalni modeli za proučavanje molekularno-bioloških procesa starenja su kvasac (Saccharomyces cerevisiae) koji ima sveukupno 6000 gena, crv oblić Caenorhabditis elegans (ima više od 40%-tnu homologiju s genomom čovjeka), vinska mušica (Drosophila melanogaster) koja je zbog najveće molekule DNA u prirodi (41 x 10na9-tu kDa) najvažniji genetski model uopće, i naravno miš (Mus musculus).
4. Mehanizmi staničnog starenja u mitotički aktivnih stanica
Osim što različite stanice različito brzo stare one to čine i na različite načine: postmitotičke (kao što je to većina mišićnih i živčanih stanica) više zbog utjecaja izvanstaničnih i unutarstaničnih oštećenja koja se kumuliraju tijekom vremena, a mitotički aktivne stanice više zbog genetske nestabilnosti i trošenja telomera. Istina je možda negdje na sredini: npr. moguće je da različite vrste oštećenja pokrenu određene genetske programe koji dovode do starenja, a i na svim drugim razinama analize ova se dva utjecaja međusobno nadopunjuju. U tijelu čovjeka dosad je klasificirano više od 600 morfološki i biokemijski različitih tipova stanica, a svaki od njih vjerojatno na svoj način utječe na starenje cijelog organizma. Najbolji model za proučavanje genetike starenja u mitotički visoko aktivnih stanica je kvasac (S. cerevisiae) jer su individualne stanice kvasca smrtne (prije se nije mislilo tako), stupanj smrtnosti točno prati Gompertz-Makehamovu krivulju, a stanice sa starenjem prolaze kroz karakteristične morfološke i biokemijske promjene po kojima se može precizno odrediti koliko je pojedina stanica stara. Ove promjene obuhvaćaju akumulaciju ožiljaka koji nastaju od stanica kćeri prilikom asimetrične diobe (pupanja i odvajanja stanica kćeri), nastup sterilnosti ulijed utišavanja oba lokusa za parenje na 3-ćem kromosomu, te usporavanje staničnog ciklusa (što se vidi po dramatičnom povećanju veličine stanica). Povrh toga razvijena je vrlo praktična metoda razdvajanja stanica na temelju starosti magnetskim sortiranjem nakon biotinizacije. Sitnopostrojbenom analizom DNA (engl. microarray DNA chips) za svaki od 6000 gena kvasca utvrđena je razina mRNA tijekom starenja. Na taj način je pokazano da samo manji broj gena ima moguci ucinak na starenje.
Prilikom proučavanja starenja stanica kvasca vrlo je rano uočeno da stanice kćeri vrlo starih stanica majki imaju skraćen životni vijek, te da je ova pojava reverzibilna jer već druga i treća generacija stanica koje su nastale od tih kćeri ima normalno trajanje života. Stoga je pretpostavljeno da postoji neki 'citoplazmatski činitelj starenja' koji se kumulira u stanicama tijekom vremena i uzrokuje starenje, a njegovo eventualno 'razrjeđenje' novim diobama dovodi ponovno do normalno očekivanog trajanja života. Curenje ove tvari u stanice kćeri događa se samo prilikom posljednjih nekoliko dioba stare stanice majke. Nakon dugog niza godina istraživanja pokazano je da je uzrok starenja kvasca ispadanje 150-200 kratkih ponavljajućih slijedova na kromosomu 12, a koji su uključeni u kodiranje rDNA. To se ispadanje dogodi negdje oko sredine životnog vijeka kvasca, a ta ERC (izvankromosomska kružna DNA, extrachromosomal DNA circle) dalje se sama umnaža. Kad broj ERC dosegne između 500 i 1000 kopija, dolazi do velikog povećanja nukleolusa i njegove fragmentacije, a kvasac umire. Pretpostavlja se da sama smrt nastaje zbog titracije nekog esencijalnog transkripcijskog ili replikacijskog činitelja, ali on još uvijek nije poznat. ERC su tijekom starenja segregirani tako da nikad ne dodu u stanice kćeri, osim u nekoliko posljednjih diobi (curenje 'činitelja starenja'). Zaključci koji se mogu izvući iz navedenih eksperimentalnih podataka u kvasca su sljedeći: a) proces starenja može biti vrlo jednostavan i b) u kvasca možda postoji jedan jedini mehanizam koji uzrokuje starenje, a posljedično i mutacija jednog gena može dramaticno ubrzati ili usporiti starenje. Tako npr. kad se Sgs1 gen kvasca, koji je visokohomologan WRN genu u čovjeka (oba se nalaze u jezgrici) ciljano mutira, to dovodi do neuklanjanja sekundarnih struktura koje nastaju tijekom replikacije DNA (što inače obavlja DNA helikaza), te rekombinacija i stvaranja ERC i preuranjenog starenja uslijed nakupljanja ERC i sterilnosti zbog gubitka utišavanja gena na lokusu za razmnožavanje Mat-a ili MAT alfa. U ovom ekperimentalnom modelu delecija SIR gena (SIR2, SIR3, SIR4) dovodi također do značajnog produljenja života vjerojatno zbog sprječavanja nastanka i nakupljanja ERCs uslijed sprječavanja prve ekscizije ERC, utišavanja rDNA transkripcije i odgađanja stvaranja nestabilnosti. Dokazano je i suprotno: umjetno stvaranje ERC pomocu specifičnih rekombinaza dovodi do preuranjenog starenja. Model genetske nestabilnosti kao primarni pokretač starenja u sisavaca možda bi se eventualno mogao pokušati primijeniti samo na stanice koje se učestalo dijele (analog stanica kvasca bila bi zapravo matična stanica mitotički aktivnih organa), no (nažalost) čak ni u njima nema dramatične akumulacije nikakve cirkularne DNA sa starenjem.
Zbog biokemijskih svojstava otvorenih krajeva linearnih molekula DNA, njihovo je održavanje u eukariotskih stanica vezano uz niz teškoća kao što su podložnost razgradnji enzimima, sljepljivanje s krajevima drugih kromosoma, te pogrešno prepoznavanje otvorenih krajeva DNA kao oštećenje genetskog materijala. To se ipak ne dogada jer se na završecima molekule DNA nalaze telomere, ponavljajući sljedovi DNA. U svih kralježnjaka, a takoder i nekih beskralježnjaka, npr. školjkaša i bodljikaša, te nekih praživotinja i gljivica to je slijed TTAAGG, u kukaca TTAGG, a u biljaka TTTAGGG. U tim sljedovima nema gena niti su isprekidani nikakvim drugim sljedovima, a uzastopno se ponavljaju od nekoliko stotina do nekoliko tisuća puta štiteći krajeve kromosoma poput kape. No, telomere DNA polimeraze ne mogu potpuno replicirati prilikom diobe jer dodaju nukleotide samo u jednom smjeru pa se sa svakom diobom DNA telomere skraćuje za duljinu jednolančanog završetka. Njihovu duljinu nadoknađuje ribonukleoprotein telomeraza (koja prepoznaje ove jednolančane krajeve), a njezina je aktivnost izuzetno slaba u većini somatskih stanica starijih ljudi. Telomeraza je stalno aktivna samo u spolnim stanicama (jajnim stanicama i spermijima), te u stanicama zloćudnih tumora (što otvara mogućnosti da bi se inhibicijom telomeraze možda mogao zaustaviti rast tumora) i nekim drugim stanicama koje se stalno dijele, npr. krvotvornim (reaktivacija telomerazne aktivnosti u kulturama ljudskih stanica dovodi do značajnog povećanja njihova kapaciteta diobe, tako da neke postaju gotovo besmrtne). Spolne stanice imaju najdulje telomerne nizove stalne duljine, a njihova duljina je svojstvena za vrstu. Iz ovih nalaza se pretpostavilo da je skraćivanje telomera možda molekularni sat koji signalizira prestanak rasta, odnosno diobe, odgovoran za starenje mitotički aktivnih stanica (tzv. replikativno starenje). Za razliku od životinja u kojih se telomere skraćuju pri svakoj diobi, u biljaka je duljina telomera zbog stalne ekspresije gena za telomerazu nepromijenjena u stanicama svih tkiva. Drvo sekvoje, npr., nema ograničenja u potencijalu diobe: stanice mu se bez teškoća dijele više od 4000 godina. Superiorni potencijal diobe biljnih stanica u odnosu na životinjske vidi se i iz činjenice da nova biljka može nastati i iz stanica korijena koje se ne dijele ako im se osiguraju primjereni uvjeti, dakle potencijalno su besmrtne (što je naravno neophodno i za održanje životinjskog svijeta). Pa ipak, nakon početnog oduševljenja, na svjetlo dana su izašli i nalazi koji govore protiv tvrdnje da bi skraćivanje telomera moglo biti uzrokom starenja jer npr. nema jasne korelacije izmedu starosti donora i replikativnog starenja njegovih stanica, većina progeroidnih stanica u kulturi izađe iz staničnog ciklusa i umre i prije nego li im se skrate telomere, miševi bez gena za telomerazu ne pokazuju odstupanja od normalnih, osim za mitotički visoko-aktivna tkiva i to tek u poodmakloj dobi (testis, koža i hematopoetski sustav). U svakom slučaju zbog nedostatnog znanja o procesima genetski programiranog skraćivanja telomera, pokušaj njihovog produljivanja u covjeka bi zasad bio vrlo opasan jer bi time došlo i do porasta učestalosti zloćudnih tumora (a kad bi i uspjeli zaštititi telomere od skraćivanja, to ne bi imalo nikakve koristi za većinu živčanih, mišićnih i drugih postmitotičkih stanica).
5. Mehanizmi starenja u mitotički neaktivnih stanica
Sve su živčane stanice postmitotičke u trenutku rođenja (osim prvog neurona njušnog puta, zrnatih stanica girusa dentatusa i vjerojatno zrnatih stanica malog mozga) i zbog toga su najosjetljivije na kumulativno oštećenje slobodnim radikalima kisika (a zatim su to srčane mišićne stanice). Pretpostavlja se da će se u doglednoj budućnosti iz matičnih stanica moći nadomjestiti većina tkiva i organa (analogija s autom koji vječno traje samo što više nema originalne dijelove), no to za mozak nije izgledno, odnosno neće polučiti željene rezultate (jer se time neće moći vratiti iskustvo zapisano putem jedinstvenih sinaptičkih veza neurona). No, to je možda ujedno i velika prilika da se brzo dode do produljenja života moždanih i srčanih stanica, npr. sprječavanjem oksidativnog oštećenja. U tom smislu, iako njegovo djelovanje još uvijek nije dokazano u velikim, dvostruko-slijepim multicentričnim studijama, nade se polažu u melatonin, jedini antioksidans koji (za razliku od vitamina C i E i ostalih antioksidansa) prolazi krvno-moždanu barijeru (u SAD-u se kupuje masovno i bez recepta kao dodatak prehrani, ali njegova prodaja nije dopuštena u Europskoj uniji). Poznato je da miš bez melatonina ima skraćen životni vijek uslijed povećane učestalosti nastanka zloćudnih tumora.
5.1. Oksidativno oštećenje slobodnim radikalima kisika
Oksidativno oštećenje stanica posljedica je evolucijskog 'pronalaska' da redukcija kisika u vodu daje stanicama najveći iznos biološki korisne energije. No, on istovremeno ima i jednu manu koja sa stajališta evolucije nije bitna jer se dogada nakon reprodukcije, a to je da pritom nastaju nepotpuno reducirani kisikovi spojevi (ROS, reactive oxygen species). Najvažniji ROS su (prema reaktivnosti): superoksidni anion O2-., hidroksilni radikal OH-., dušični monoksid NO., singularni kisik 1/2 O2., te alkoksilni i peroksilni radikali RO. i ROO., a u širem kontekstu takoder su bitni i (prema reaktivnosti): peroksinitritni radikal ONOO-, vodikov peroksid H2O2 i molekularni kisik O2. ROS oštećuju lipide oksidacijom, a proteine i DNA oksidacijom, dekarboksilacijom i deaminacijom, što na kraju završava cijepanjem lanaca DNA. Teoriju starenja zbog stvaranja slobodnih radikala prvi je predložio Harman 1955. godine (a budući da se njome pokušavalo objasniti ne samo starenje, nego i brojne neurodegenerativne bolesti, dulji životni vijek u žena i druge poremećaje, kasnije je prozvana i teorijom svega i svačega, engl. theory of everything, Harman, 1981). Ovaj kumulativni mehanizam primarno djeluje na postmitotičke stanice, naročito neurone, a nije pronađen njegov direktni utjecaj na stanice koje se dijele. Neki od dokaza koji podupiru teoriju oksidativnog oštećenja kao glavnog mehanizma starenja živčanih stanica su sljedeći: transgenična vinska mušica s ubačenim genima za Cu/Zn superoksid dismutazu i katalazu (to su, pored glutation reduktaze, dva najvažnija antioksidativna enzima) živi 34% dulje od kontrola; umetanje ljudske superoksid dismutaze u motoričke neurone drozofile povećalo im je životni vijek za 40%; mutacije gena AGE-1 (za PI3 kinazu) i DAF-2 (za inzulinu-sličan receptor) mogu produljiti život i za 4 puta u C. elegans, jer ovakve mutante pokazuju pojačanu otpornost na oksidativno oštećenje. Postmortalnom analizom moždanog tkiva čovjeka pomoću biljega oksidativnog stresa kao što su nitrotirozin, 8-hidroksi-2'-deoksigvanozin (8OHdG) i drugih, takoder je dokazana veća količina produkata oksidacije neurona u starijih osoba u odnosu na mlađe. Ovo je naročito izraženo u monoaminergičkim neuronima, zbog toga što oni značajno više od ostalih neurona eksprimiraju enzime monoaminooksidazu A i B, koje kao nusprodukt svoga djelovanja oslobađaju vodikov peroksid (što se lijepo vidi u tzv. MPTP modelu toksičnosti, ujedno najboljem ekperimentalnom modelu Parkinsonove bolesti, ali također i u normalnom starenju u obliku povećanog stvaranja i nakupljanja lipoproteinskih pigmenata lipofuscina i neuromelanina).
5.2. Mutacije mitohondrijalne DNA
Ovo je zapravo model genetske nestabilnosti, ali izvan genoma u jezgri, a počiva na zapažanju da je uobičajeni stupanj mutacija mtDNA oko 10-20 puta veći nego nuklearne DNA, što je vjerojatno posljedica proizvodnje slobodnih radikala kisika. Defekti koji tako nastaju dovode do oštećenja transporta elektrona i oksidativne fosforilacije, te smanjene produkcije ATPa i omjera NAD/NADH, s posljedičnim povećavanjem koncentracije ROS. No, iako se mitohondrijalne mutacije povećavaju s godinama ima i oprečnih rezultata. Naime, neka istraživanja su pokazala da je zahvaćeno manje od 1% mitohondrijalnog genoma u najviše 12% mitohondrija. Budući da stanice sadrže stotine i tisuće mitohondrijskih genoma, a istraživanja nasljednih mitohondrijalnih bolesti pokazuju da najmanje 50-80% mitohondrija mora biti zahvaćeno da bi došlo do fenotipskog izražaja, postavlja se pitanje bi li takvo oštećenje moglo biti dovoljno da bi bilo značajno. S druge strane su pak studije u kojima su uzimana pojedinačna stara mišićna vlakna, a lančana reakcija polimeraze pokazala je da i više od 50% mitohondrijalnog genoma zna biti mutirano, što ovakve postmitotičke stanice ne mogu ni popraviti ni zamijeniti. O važnoj ulozi mitohondrija u procesu starenja mitotički neaktivnih stanica govori u prilog i nalaz da ubačeni CLK1 gen za koenzim Q u lancu transporta elektrona u mitohondrijima u C. elegans usporava metabolizam, te produljuje život C. elegans za oko 30%. Također, od samih početaka sustavnog proučavanja Alzheimerove bolesti dobro je poznata činjenica da puno veći rizik za nastanak bolesti imaju osobe kojima je majka oboljela od Alzheimerove bolesti, a ne otac, što je očigledno povezano s mutacijama mtDNA i energijskim metabolizmom.
6. 'Normalno' starenje i budućnost istraživanja procesa starenja čovjeka
U tijeku normalnog starenja može se u neuropatološkom nalazu primijetiti niz promjena koje se u najvećoj mjeri sastoje od nakupljanja proteina koji se ne mogu razgraditi. Neke od takvih univerzalnih histoloških promjena mozga su nakupljanje lipofuscina (što se sastoji većinom od oksidiranih proteina i lipida):
Lipofuscin
neuromelanina (nusprodukta sinteze katekolamina - stoga ga se najviše vidi u neuronima crne jezgre):
Neuromelanin
corpora amylacea (Manolescu-ova tjelešca):
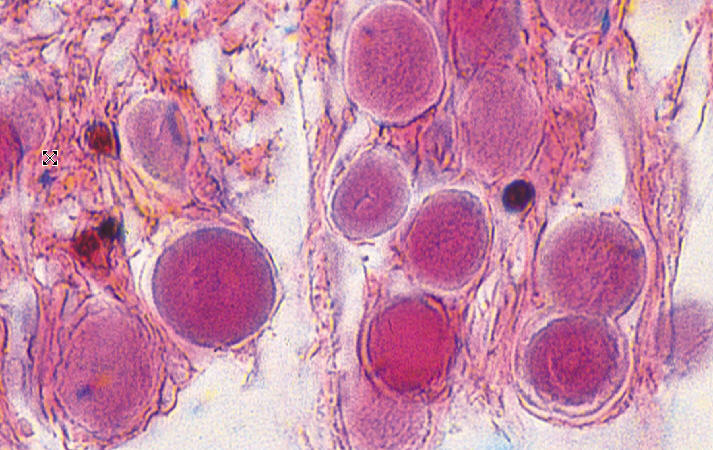
Corpora amylacea
leukoaraioza (vaskularne promjene malih krvnih žila uslijed hijalinih arteriosklerotskih promjena s nastankom tortuoziteta), ireverzibilna glikozilacija proteina, neurofibrilarna degeneracija zvjezdolikih neurona entorinalne moždane kore i piramidnih neurona CA1 i CA2 područja hipokampusa, a također i umjerena reaktivna astroglioza.
Zahvaljujući razvitku mikrosatelitnih markera DNA, te integracijom genetskih i fizičkih mapa DNA i analize polimorfizama pomocu sitnopostrojbene analize DNA u starih osoba predviđa se da će se uskoro precizno otkriti geni povezani sa starenjem. Za sada znamo da su to apolipoprotein E (apoE), ACE (angiotenzin-konvertirajući enzim), HLA-DR (leukocitni antigen) i PAI-1 (inhibitor aktivatora plazminogena). Treba također očekivati da će se genskom terapijom, tj. manipulacijom ovih i drugih, još neotkrivenih gena, u budućnosti moći značajno produljiti i čovjekov životni vijek, no to će zasigurno izazvati i moralne dvojbe oko korištenja ovakvih postupaka.
Nakon što su Ian Wilmut i Keith Campbell 1996. godine klonirali ovcu Dolly iz somatske stanice vimena, a 1997. godine Yanagimachi i suradnici miša, do danas je još nekoliko vrsti sisavaca klonirano sa sličnom uspješnošcu od oko 0.5-1% (tj. na dvjestotinjak transfera jezgre somatske stanice u jajnu stanicu razvije se tek jedan klon). Pa ipak, uspjeh ovog postupka znači da su promjene nuklearne DNA reverzibilne, tj. da se spajanjem s jajnom stanicom moguće vratiti na 'početak' genetskog programa. No, kako svi klonovi nemaju isti životni vijek, tj. neki stare normalno, neki brže, a neki sporije (npr. klonirano tele), ovaj nalaz upućuje da su možda neke somatske stanice izbjegle promjene povezane sa starenjem.
Budućnost istraživanja procesa starenja također predstavljaja i proučavanje uspjelih 'prirodnih eksperimenata' dugovječnosti. Jedan od takvih je sigurno i golokrtičasti štakor (Heterocephalus glaber) koji živi dulje od 20 godina, a neki primjerci opisani 2002. godine imali su 26 godina i još uvijek žive. Pretpostavlja se da je uzrok dugovječnosti tih štakora kombinacija iznimno sporog metabolizma (i time smanjenog oksidativnog oštećenja), te života u dobro zaštićenim nastambama pod zemljom. Prilikom pokušaja preslikavanja rezultata s glodavaca na čovjeka treba ipak imati na umu da je stupanj divergencije glodavaca od današnjeg čovjeka veći od 100 milijuna godina. Stoga se traženje istih mehanizama starenja u obje vrste može lako pretvoriti u metodološku grešku. Ovo ne znači da istraživanja nižih vrsta nemaju smisao u razumijevanju starenja čovjeka jer neki mehanizmi mogu biti visoko konzervirani. Ipak, općenito se može reći da, kako se penjemo više na filogenetskoj ljestvici, tako su i mehanizmi kontrole i regulacije starenja sve složeniji.

Heterocephalus glaber
Odgovor na pitanje koliki bi točno bio utjecaj naslijeđa na dugovječnost pokušala je dati i jedna epidemiološka studija u kojoj je istraživan utjecaj naslijeđa na uzorku od 218 jednojajčanih i 382 dvojajčana danska blizanca što su rođeni u razdoblju 1870.-1880. godine. Rezultati su pokazali da je razlika u dobi s kojom su umrli jednojajčani blizanci bila značajno manja od one za dvojajčane. Izračunati utjecaj naslijeđa na varijabilnost doživljene dobi iznosio je 26% za muškarce i 23% za žene. Preostali utjecaj se dakle odnosi na činitelje okoline, odnosno način života. Koliko velik utjecaj okolinskih činitelja može biti na trajanje života zorno ilustrira ciklus C. elegans (crv oblić dugačak 1 mm, hermafrodit, hrani se bakterijama) u kojemu koncentracija feromona u zraku (što zavisi od temperature, napučenosti, stupnja sitosti, itd.) putem kontrole regulacije transkripcije gena može produljiti ostanak u stadiju larve i za 6 mjeseci (cijeli život mu inače traje oko 10 dana). Da činitelji okoline imaju veliku ulogu i u nastanku Alzheimerove i drugih bolesti mozga povezanih sa starenjem potvrđuje i činjenica da je konkordancija za Alzheimerovu bolest relativno mala: u monozigotnih blizanaca iznosi 59-67%, a u dizigotnih 22-40%. Čak i kad oba blizanca obole, ponekad i vrlo velik razmak izmedu obolijevanja, te velika različitost patoloških promjena unutar porodica s dominantnim naslijeđivanjem, upućuju na značajnu uključenost činitelja okoline u patogenezi bolesti.